新着情報
Informations

雑誌会
2025.04.08
海水からリチウム
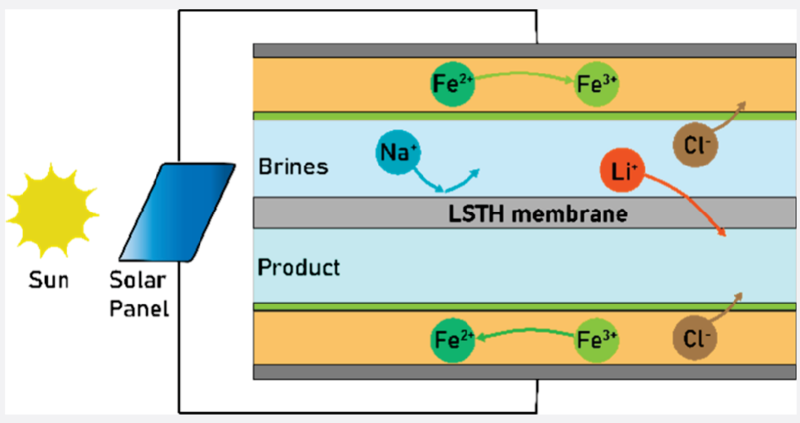
ナトリウムイオンなど高濃度で他のイオンが共存している状態でリチウムイオンだけを取り出そうとしたお話です。
Ecofriendly, Highly Selective Lithium Extraction by Redox-Mediated Electrodialysis
Rongxuan Xie, Danyi Sun, Jinyao Tang, Xiaochen Shen, Parsa Pishva, Yanlin Zhu, Kevin Huang,* and Zhenmeng Peng*
ACS Cent. Sci. 2024, 10, 2119−2124
(本文)
https://pubs.acs.org/doi/epdf/10.1021/acscentsci.4c01373?ref=article_openPDF
(追加情報-1)
https://pubs.acs.org/doi/suppl/10.1021/acscentsci.4c01373/suppl_file/oc4c01373_si_001.pdf
(追加情報-2)
https://pubs.acs.org/doi/suppl/10.1021/acscentsci.4c01373/suppl_file/oc4c01373_si_002.pdf
リチウムイオン電池など、リチウムの需要は非常に高いです。今後もその傾向が続くようです。(図1a)
しかしながら、『リチウム資源の埋蔵量は偏在しており、我が国はそのほとんどを南米・チリからの鉱石輸入に依存しています。今後の世界的なリチウム需要の増加を考えると、偏在性と独占的供給による商業的な需給ギャップが懸念されることから、最近、中国の輸出制限で話題になったレアアースと同じように、資源調達の多様化を図る必要性が指摘されています。』『リチウムは陸上の推定埋蔵量1,400万トンに対して、海水中には2,300億トンも溶けていますが、海水1リットル当たり0.1~0.2ミリグラムと濃度が低いのが難点です。 しかし、コストの面で実用的な回収方法が開発されれば、リチウムの国内自給も夢ではありません。そこで、海水からリチウムを回収しようという話が出てくるわけです。』『今、日本にある発電所の排水や海流発電、潮流発電などを利用する手が考えられますが、私は、将来の海洋エネルギー利用技術として期待されている海洋温度差発電(OTEC)を使うことができればと思っています。出力100万kW規模で、冷海水と温海水を合わせれば、なっ!何と3,000 m3/秒の海水を使うのです。これらの海水に溶けているリチウムの全量が回収できたとすれば、出力100万kWで年間24時間運転された場合、海洋温度差発電では、なんと日本の年間輸入量に匹敵する18,000トンが回収できることになります。』とあります。
(海水からのリチウムを回収する話)
http://www.fpo.jf-net.ne.jp/soumu/column/column004.html
要は海水中にはリチウムイオンは存在しているが、ごく微量であり、回収するには大量の海水が必要とされ、それを動員するには大量の電力が必要ということのようです。
そのような課題に取り組んだ研究例のようです。
まず、リチウムの由来ですが、図1bに見られますように、かん水(Brine、水に多量の塩分を含む湖などから採取)によるものが多数を占めていることがわかります。
かん水からリチウムを得る模式図が図1cに描かれています。このプロセスには、長期間の操業(通常2~3年)、広大な土地占有面積、多量の化学物質の使用が必要とされ、経済性に影響を及ぼすとともに、環境への懸念が高まっているようです。
下記資料には更に詳しく書かれていますが、とにかく手間がかかり、大変なことがわかります。
(塩湖かん水からのリチウム生産の現状)
https://mric.jogmec.go.jp/kouenkai_index/2009/briefing_090730_6.pdf
一方で、海水のようは豊富な資源にもリチウムは含まれているものの、リチウム濃度は極めて低く、通常0.1~0.2ppmみたいです。さらに、Na+、K+、Mg2+、Ca2+などの競合イオンが大量に存在することにより、抽出プロセスをさらに困難にしているようです。
そこで今回の研究例では、様々な食塩水源からリチウムをエネルギー効率よく、連続的に、レドックス媒介電気透析(rm-ED)法を採用して検討したようです。この方法は、高密度セラミックLi6/16Sr7/16Ta3/4Hf1/4O3(LSTH)ペロブスカイト膜を使用し、界面でのリチウムイオン交換のみを可能にできるようです。また、化学物質を一切消費せず、廃棄物も出さず、再生可能エネルギーで駆動できるため、環境に優しいとされています。
まず、図1dのような装置にかん水を通せば、様々なイオンが含まれていたにもかかわらず、LiClのみを取り出すことができたようです。
部品の構成はアニオン広間膜(AEM)とLSTHから成り立っているようです。
特に重要なのは高密度セラミックLi6/16Sr7/16Ta3/4Hf1/4O3(LSTH)ペロブスカイト膜で、作り方は過去の研究例に基づいたようです。
Sun, D.; Wu, N.; Qin, C.; White, R.; Huang, K. Synthesis and Characterization of Impurity-Free
Li6/16Sr7/16Ta3/4Hf1/4O3 Perovskite as a Solid-State Lithium-Ion Conductor. Energy Technology 2023, 11 (6), 2201455.
https://onlinelibrary.wiley.com/doi/full/10.1002/ente.202201455
概略は下記のようです。
(1)高純度の Li₂CO₃、SrCO₃、HfO₂、および Ta₂O₅ を準備。
(2)化学量論量を揃えてエタノール中で乳鉢と乳棒を使用してよく混合、粉砕。
(3)混合粉末を冷間静水圧プレスによって 200 MPa でペレット化。
(4)ジルコニアるつぼを使用して空気中で 900°C で 6 時間焼成。
(5)LSTHペレットの上、およびLSTHとジルコニアるつぼの間に、LSTHの約3倍のマザー・パウダー・ベッド(MPB)粉末を配置した。
(6)予備焼成後、微粉化ミル (McCrone Microscopes & Accessories) を使用してサンプルの粒子サイズを小型化。
(7)サンプルを 200 MPa でペレットにプレスし、1350°C で焼結。
パウダー・ベッドについてですが、『Powder Bed Fusion=粉末床溶融結合。粉末を敷いたある領域を、熱エネルギーによって選択的に溶融結合させる方法。』
とあります。
https://www.fklab.fukui.fukui.jp/kougi/3dtrial/am05.pdf
LSTHの構造が図1eに出ています。LSTH 膜の格子特異性はリチウムイオンのみの交換であるため、他のすべてのイオンの通過が制限され、他のイオンは塩水流に保持され、リチウムイオンのみが抽出流に浸透するとあります。
これについて、LSTH膜は、ペロブスカイト格子構造のAサイト欠損Li6/16Sr7/16Ta3/4Hf1/4O3として特徴付けられるようで、0.408 mS·cm−1という良好なバルクイオン伝導率を示したようです。(追加情報の図S7、表S1)。膜は滑らかな微細構造表面を備えていたようです。(図S8)0.1 M HClの水溶液中にLSTH幕を14日間浸して外観、組成、構造の変化が最小限であったことから、酸性環境と中性環境の両方で優れた安定性があったようです。(追加情報の図S9とS10)。
密度汎関数理論 (DFT) シミュレーションによると、リチウムイオンは、ナトリウムイオン (Ea = 1.80 eV) などの他のほとんどの陽イオンと比較してエネルギー障壁が大幅に低い (Ea = 0.77 eV) ため、溶液から LSTH 界面格子に優先的に交換され、優れたリチウム選択性をもたらします。さらに、リチウムイオンが LSTH 格子内の隣接サイト間を移動するためのエネルギー障壁が 0.14 eV と低いことから、その高い移動性が示唆され、膜を介したリチウムイオンの効率的な輸送が保証されるようです。図1fはLSTHを介したリチウムイオン交換と輸送経路のDFTシミュレーションの結果のようです。
DFTについては、『Density Functional Theoryの略語で、密度汎関数理論のこと。電子系のエネルギーなどの物性を電子密度から計算することができるとする理論。』とあります。
(分子シミュレーション&インフォマティクス 用語解説)
https://www.itec.daikin.co.jp/SC/glossary/dft.html
てなことで、図1dに示されるような装置を用いて『レドックス媒介電気透析』という手法での検討を進めたようです。
まず電気透析ですが、『溶解中のイオン性物質と、イオン交換膜が陽イオンと陰イオンを選択して透過させる性質を利用する分離技術を利用して、水に溶けているイオン成分(ナトリウム、カルシウムなどの無機塩類やアミノ酸など)を濃縮したり反対に除去する電気透析。』とあります。
(電気透析装置とは)
https://www.sunactis.co.jp/technical_info/index2.html
今回の研究例では、電気透析における単なる陽イオンと陰イオンの選別のみならず、陽イオンの中でもリチウムイオンのみを選択することを目指したようです。
最初に、流す塩水のリチウムイオン濃度やセル電圧、競合するカチオンがリチウム抽出特性に与える影響を調べたようです。
10 mM LiCl 塩水流を 装置に供給した場合、リチウム抽出速度 = 88 mmol·h−1·m−2(図2a)、エネルギー消費 = 0.23 kWh·mol−1 (図2b)だったようです。
200 mM LiCl 塩水流ではリチウム抽出速度は 320 mmol·h−1·m−2 と大幅に上昇し、一方、エネルギー消費は0.14 kWh·mol−1 と低下しました。塩水濃度が上昇するにつれて充電効率が上昇(追加情報の図S12)するのは、塩水濃度が上昇するにつれてリチウムイオンが LSTH 膜界面と結合する可能性が高くなり、その結果、イオン交換と輸送が加速され、抽出率とエネルギー効率の両方が向上したと考察しています。
図2cでは印可電圧とリチウムイオンの抽出速度の関係が描かれています。0.5 V では抽出速度は17.1 mmol·h−1·m−2 でしたが、電圧を上げると上昇し、10 Vでの速度は 287 mmol·h−1·m−2 だったようです。これについては、印加電圧によって発生する電荷の不均衡がイオン移動の主な推進力として作用するのでは?と考察しています。電圧が高いほど、Fe2+/Fe3+ の酸化還元速度が加速され、生成された電荷の不均衡が強まるようです。その結果、セル全体に強い電界が形成され、リチウムイオン抽出プロセスが増強されると考察しています。
一方、図2dに見られますように、セル電圧が上昇するにつれてエネルギー消費も増加したようです。その値は 0.5 V で 0.014 kWh·mol−1、10 V で 0.40 kWh·mol−1 の範囲だったようです。エネルギー消費の増加は、電圧の上昇とともに、セル電流が増加し、抵抗損失がより顕著になり、充電効率が徐々に低下し (追加情報の図 S15)、結果的にエネルギー利用効率が低下したようです。故にリチウム抽出率とエネルギー消費の間にはトレードオフが存在し、これはセル電圧を調整することで管理することを提案しています。
続いて、塩水の中にリチウムイオンのみならず、ナトリウムイオンも共存した場合のリチウムイオンの抽出状況を調べています。図2eに示されているように、競合する Na+ イオンのさまざまな濃度を上昇させても、抽出されたリチウムは一貫して 99% を超える純度だったようです。また、ナトリウムイオン濃度が増大しても影響されることなく、リチウムイオン抽出速度は200 mmol·h−1·m2前後(図2fの折れ線グラフ)、エネルギー消費量は0.17 kWh·mol−1前後(図2fの棒グラフ)、充電効率(追加情報の図S18)は90% 前後と安定していたようです。
そして、ナトリウムイオン以外として、カリウムイオン、カルシウムイオン、マグネシウムイオンでも検討したところ、いずれの場合もナトリウムイオン同様に優れたリチウムイオン選択性が確認されたようです。(追加情報の図S19とS20)
更に、世界各地で採取される塩水をまねて各溶液を調製したようです。(図3aの横棒グラフ、追加情報の表3)
組成構成が場所によって違うことがわかります。リチウム抽出速度は、チリ アタカマ塩水で 320 mmol·h−1·m−2、CHN タイジナールで 211 mmol·h−1·m−2、米国ボンネビルで 63 mmol·h−1·m−2、海水で 7 mmol·h−1·m−2 と測定されました。(図 3aの折れ線グラフ)
一方、エネルギー消費はリチウム抽出速度とは逆順となったようで、海水からの場合が最も多い0.34 kWh·mol−1、チリ アタカマからの場合が最も少ない 0.14 kWh·mol−1 だったようです。(図 3b)
そして、いずれの場合も抽出されたリチウムの純度は100% 近くとなり、LSTH 膜がさまざまな陽イオンに対して高い選択性を持っていることが確認されたようです。(図 3c)
今回の研究例の装置は連続運転が可能であることが特徴のようです。図3dに示されているように、リチウム抽出率は最初は 6 mmol·h−1·m−2 だったようですが、50 時間の操作で徐々に初期値の 83% まで低下したようです。最も、これは、塩水流内のリチウム濃度も低下したので、それにスライドした結果ではないか?と考察しています。
また、リチウム濃度は抽出実施中は着実に増加し、最終的に模擬海水中の初期リチウム濃度の 43 倍に達したようです。(図 3e)特にリチウム純度が操作全体を通じて一貫して 100% 近くを維持していたことは特筆すべきことで、並外れた選択性と安定性が得られたようです。
図4aには、システムの電源を再生エネルギーとした場合の結果が示されています。市販の 6.0 V ソーラーパネルを利用した場合、6.8 mmol·h−1·m2 のリチウム抽出速度となり、50 時間の動作後には、模擬海水中のリチウムの初期濃度の 59 倍まで行ったようです。(図 4a )。
最後に、今回の研究例の手法の優位性について、図4bで説明しています。
(1)化学物質を消費せず、廃棄物を生成しないことで環境に優しく、再生可能エネルギー源を利用も可能。
(2)操作が効率的で、抽出後の分離が不要なため、無駄なエネルギー消費がなく、費用対効果に優れている。
(3)選択性が高いため、純粋なリチウム抽出が保証され、不純物が最小限に抑えられる。
(4)スケールアップにも対応可能。
といったところのようです。
所感です。
電極の間に液を流すだけで、純度の高いリチウムイオンを選択席に取り込めることは非常に興味深い結果です。装置構成や操作が簡便であることは実用性が極めて高いと思われます。
ただ、最も重要な心臓部分は高密度セラミックLi6/16Sr7/16Ta3/4Hf1/4O3(LSTH)ペロブスカイト膜であったことです。ただ、今回の研究例ではこのLSTHがどのようにして開発されたのか?その経緯を把握できませんでした。少しばかり調べても見たのですが、良くわかっておりません。もし詳しい方はおられましたら、是非ともご教示いただければ幸いに存じます。
Ecofriendly, Highly Selective Lithium Extraction by Redox-Mediated Electrodialysis
Rongxuan Xie, Danyi Sun, Jinyao Tang, Xiaochen Shen, Parsa Pishva, Yanlin Zhu, Kevin Huang,* and Zhenmeng Peng*
ACS Cent. Sci. 2024, 10, 2119−2124
(本文)
https://pubs.acs.org/doi/epdf/10.1021/acscentsci.4c01373?ref=article_openPDF
(追加情報-1)
https://pubs.acs.org/doi/suppl/10.1021/acscentsci.4c01373/suppl_file/oc4c01373_si_001.pdf
(追加情報-2)
https://pubs.acs.org/doi/suppl/10.1021/acscentsci.4c01373/suppl_file/oc4c01373_si_002.pdf
リチウムイオン電池など、リチウムの需要は非常に高いです。今後もその傾向が続くようです。(図1a)
しかしながら、『リチウム資源の埋蔵量は偏在しており、我が国はそのほとんどを南米・チリからの鉱石輸入に依存しています。今後の世界的なリチウム需要の増加を考えると、偏在性と独占的供給による商業的な需給ギャップが懸念されることから、最近、中国の輸出制限で話題になったレアアースと同じように、資源調達の多様化を図る必要性が指摘されています。』『リチウムは陸上の推定埋蔵量1,400万トンに対して、海水中には2,300億トンも溶けていますが、海水1リットル当たり0.1~0.2ミリグラムと濃度が低いのが難点です。 しかし、コストの面で実用的な回収方法が開発されれば、リチウムの国内自給も夢ではありません。そこで、海水からリチウムを回収しようという話が出てくるわけです。』『今、日本にある発電所の排水や海流発電、潮流発電などを利用する手が考えられますが、私は、将来の海洋エネルギー利用技術として期待されている海洋温度差発電(OTEC)を使うことができればと思っています。出力100万kW規模で、冷海水と温海水を合わせれば、なっ!何と3,000 m3/秒の海水を使うのです。これらの海水に溶けているリチウムの全量が回収できたとすれば、出力100万kWで年間24時間運転された場合、海洋温度差発電では、なんと日本の年間輸入量に匹敵する18,000トンが回収できることになります。』とあります。
(海水からのリチウムを回収する話)
http://www.fpo.jf-net.ne.jp/soumu/column/column004.html
要は海水中にはリチウムイオンは存在しているが、ごく微量であり、回収するには大量の海水が必要とされ、それを動員するには大量の電力が必要ということのようです。
そのような課題に取り組んだ研究例のようです。
まず、リチウムの由来ですが、図1bに見られますように、かん水(Brine、水に多量の塩分を含む湖などから採取)によるものが多数を占めていることがわかります。
かん水からリチウムを得る模式図が図1cに描かれています。このプロセスには、長期間の操業(通常2~3年)、広大な土地占有面積、多量の化学物質の使用が必要とされ、経済性に影響を及ぼすとともに、環境への懸念が高まっているようです。
下記資料には更に詳しく書かれていますが、とにかく手間がかかり、大変なことがわかります。
(塩湖かん水からのリチウム生産の現状)
https://mric.jogmec.go.jp/kouenkai_index/2009/briefing_090730_6.pdf
一方で、海水のようは豊富な資源にもリチウムは含まれているものの、リチウム濃度は極めて低く、通常0.1~0.2ppmみたいです。さらに、Na+、K+、Mg2+、Ca2+などの競合イオンが大量に存在することにより、抽出プロセスをさらに困難にしているようです。
そこで今回の研究例では、様々な食塩水源からリチウムをエネルギー効率よく、連続的に、レドックス媒介電気透析(rm-ED)法を採用して検討したようです。この方法は、高密度セラミックLi6/16Sr7/16Ta3/4Hf1/4O3(LSTH)ペロブスカイト膜を使用し、界面でのリチウムイオン交換のみを可能にできるようです。また、化学物質を一切消費せず、廃棄物も出さず、再生可能エネルギーで駆動できるため、環境に優しいとされています。
まず、図1dのような装置にかん水を通せば、様々なイオンが含まれていたにもかかわらず、LiClのみを取り出すことができたようです。
部品の構成はアニオン広間膜(AEM)とLSTHから成り立っているようです。
特に重要なのは高密度セラミックLi6/16Sr7/16Ta3/4Hf1/4O3(LSTH)ペロブスカイト膜で、作り方は過去の研究例に基づいたようです。
Sun, D.; Wu, N.; Qin, C.; White, R.; Huang, K. Synthesis and Characterization of Impurity-Free
Li6/16Sr7/16Ta3/4Hf1/4O3 Perovskite as a Solid-State Lithium-Ion Conductor. Energy Technology 2023, 11 (6), 2201455.
https://onlinelibrary.wiley.com/doi/full/10.1002/ente.202201455
概略は下記のようです。
(1)高純度の Li₂CO₃、SrCO₃、HfO₂、および Ta₂O₅ を準備。
(2)化学量論量を揃えてエタノール中で乳鉢と乳棒を使用してよく混合、粉砕。
(3)混合粉末を冷間静水圧プレスによって 200 MPa でペレット化。
(4)ジルコニアるつぼを使用して空気中で 900°C で 6 時間焼成。
(5)LSTHペレットの上、およびLSTHとジルコニアるつぼの間に、LSTHの約3倍のマザー・パウダー・ベッド(MPB)粉末を配置した。
(6)予備焼成後、微粉化ミル (McCrone Microscopes & Accessories) を使用してサンプルの粒子サイズを小型化。
(7)サンプルを 200 MPa でペレットにプレスし、1350°C で焼結。
パウダー・ベッドについてですが、『Powder Bed Fusion=粉末床溶融結合。粉末を敷いたある領域を、熱エネルギーによって選択的に溶融結合させる方法。』
とあります。
https://www.fklab.fukui.fukui.jp/kougi/3dtrial/am05.pdf
LSTHの構造が図1eに出ています。LSTH 膜の格子特異性はリチウムイオンのみの交換であるため、他のすべてのイオンの通過が制限され、他のイオンは塩水流に保持され、リチウムイオンのみが抽出流に浸透するとあります。
これについて、LSTH膜は、ペロブスカイト格子構造のAサイト欠損Li6/16Sr7/16Ta3/4Hf1/4O3として特徴付けられるようで、0.408 mS·cm−1という良好なバルクイオン伝導率を示したようです。(追加情報の図S7、表S1)。膜は滑らかな微細構造表面を備えていたようです。(図S8)0.1 M HClの水溶液中にLSTH幕を14日間浸して外観、組成、構造の変化が最小限であったことから、酸性環境と中性環境の両方で優れた安定性があったようです。(追加情報の図S9とS10)。
密度汎関数理論 (DFT) シミュレーションによると、リチウムイオンは、ナトリウムイオン (Ea = 1.80 eV) などの他のほとんどの陽イオンと比較してエネルギー障壁が大幅に低い (Ea = 0.77 eV) ため、溶液から LSTH 界面格子に優先的に交換され、優れたリチウム選択性をもたらします。さらに、リチウムイオンが LSTH 格子内の隣接サイト間を移動するためのエネルギー障壁が 0.14 eV と低いことから、その高い移動性が示唆され、膜を介したリチウムイオンの効率的な輸送が保証されるようです。図1fはLSTHを介したリチウムイオン交換と輸送経路のDFTシミュレーションの結果のようです。
DFTについては、『Density Functional Theoryの略語で、密度汎関数理論のこと。電子系のエネルギーなどの物性を電子密度から計算することができるとする理論。』とあります。
(分子シミュレーション&インフォマティクス 用語解説)
https://www.itec.daikin.co.jp/SC/glossary/dft.html
てなことで、図1dに示されるような装置を用いて『レドックス媒介電気透析』という手法での検討を進めたようです。
まず電気透析ですが、『溶解中のイオン性物質と、イオン交換膜が陽イオンと陰イオンを選択して透過させる性質を利用する分離技術を利用して、水に溶けているイオン成分(ナトリウム、カルシウムなどの無機塩類やアミノ酸など)を濃縮したり反対に除去する電気透析。』とあります。
(電気透析装置とは)
https://www.sunactis.co.jp/technical_info/index2.html
今回の研究例では、電気透析における単なる陽イオンと陰イオンの選別のみならず、陽イオンの中でもリチウムイオンのみを選択することを目指したようです。
最初に、流す塩水のリチウムイオン濃度やセル電圧、競合するカチオンがリチウム抽出特性に与える影響を調べたようです。
10 mM LiCl 塩水流を 装置に供給した場合、リチウム抽出速度 = 88 mmol·h−1·m−2(図2a)、エネルギー消費 = 0.23 kWh·mol−1 (図2b)だったようです。
200 mM LiCl 塩水流ではリチウム抽出速度は 320 mmol·h−1·m−2 と大幅に上昇し、一方、エネルギー消費は0.14 kWh·mol−1 と低下しました。塩水濃度が上昇するにつれて充電効率が上昇(追加情報の図S12)するのは、塩水濃度が上昇するにつれてリチウムイオンが LSTH 膜界面と結合する可能性が高くなり、その結果、イオン交換と輸送が加速され、抽出率とエネルギー効率の両方が向上したと考察しています。
図2cでは印可電圧とリチウムイオンの抽出速度の関係が描かれています。0.5 V では抽出速度は17.1 mmol·h−1·m−2 でしたが、電圧を上げると上昇し、10 Vでの速度は 287 mmol·h−1·m−2 だったようです。これについては、印加電圧によって発生する電荷の不均衡がイオン移動の主な推進力として作用するのでは?と考察しています。電圧が高いほど、Fe2+/Fe3+ の酸化還元速度が加速され、生成された電荷の不均衡が強まるようです。その結果、セル全体に強い電界が形成され、リチウムイオン抽出プロセスが増強されると考察しています。
一方、図2dに見られますように、セル電圧が上昇するにつれてエネルギー消費も増加したようです。その値は 0.5 V で 0.014 kWh·mol−1、10 V で 0.40 kWh·mol−1 の範囲だったようです。エネルギー消費の増加は、電圧の上昇とともに、セル電流が増加し、抵抗損失がより顕著になり、充電効率が徐々に低下し (追加情報の図 S15)、結果的にエネルギー利用効率が低下したようです。故にリチウム抽出率とエネルギー消費の間にはトレードオフが存在し、これはセル電圧を調整することで管理することを提案しています。
続いて、塩水の中にリチウムイオンのみならず、ナトリウムイオンも共存した場合のリチウムイオンの抽出状況を調べています。図2eに示されているように、競合する Na+ イオンのさまざまな濃度を上昇させても、抽出されたリチウムは一貫して 99% を超える純度だったようです。また、ナトリウムイオン濃度が増大しても影響されることなく、リチウムイオン抽出速度は200 mmol·h−1·m2前後(図2fの折れ線グラフ)、エネルギー消費量は0.17 kWh·mol−1前後(図2fの棒グラフ)、充電効率(追加情報の図S18)は90% 前後と安定していたようです。
そして、ナトリウムイオン以外として、カリウムイオン、カルシウムイオン、マグネシウムイオンでも検討したところ、いずれの場合もナトリウムイオン同様に優れたリチウムイオン選択性が確認されたようです。(追加情報の図S19とS20)
更に、世界各地で採取される塩水をまねて各溶液を調製したようです。(図3aの横棒グラフ、追加情報の表3)
組成構成が場所によって違うことがわかります。リチウム抽出速度は、チリ アタカマ塩水で 320 mmol·h−1·m−2、CHN タイジナールで 211 mmol·h−1·m−2、米国ボンネビルで 63 mmol·h−1·m−2、海水で 7 mmol·h−1·m−2 と測定されました。(図 3aの折れ線グラフ)
一方、エネルギー消費はリチウム抽出速度とは逆順となったようで、海水からの場合が最も多い0.34 kWh·mol−1、チリ アタカマからの場合が最も少ない 0.14 kWh·mol−1 だったようです。(図 3b)
そして、いずれの場合も抽出されたリチウムの純度は100% 近くとなり、LSTH 膜がさまざまな陽イオンに対して高い選択性を持っていることが確認されたようです。(図 3c)
今回の研究例の装置は連続運転が可能であることが特徴のようです。図3dに示されているように、リチウム抽出率は最初は 6 mmol·h−1·m−2 だったようですが、50 時間の操作で徐々に初期値の 83% まで低下したようです。最も、これは、塩水流内のリチウム濃度も低下したので、それにスライドした結果ではないか?と考察しています。
また、リチウム濃度は抽出実施中は着実に増加し、最終的に模擬海水中の初期リチウム濃度の 43 倍に達したようです。(図 3e)特にリチウム純度が操作全体を通じて一貫して 100% 近くを維持していたことは特筆すべきことで、並外れた選択性と安定性が得られたようです。
図4aには、システムの電源を再生エネルギーとした場合の結果が示されています。市販の 6.0 V ソーラーパネルを利用した場合、6.8 mmol·h−1·m2 のリチウム抽出速度となり、50 時間の動作後には、模擬海水中のリチウムの初期濃度の 59 倍まで行ったようです。(図 4a )。
最後に、今回の研究例の手法の優位性について、図4bで説明しています。
(1)化学物質を消費せず、廃棄物を生成しないことで環境に優しく、再生可能エネルギー源を利用も可能。
(2)操作が効率的で、抽出後の分離が不要なため、無駄なエネルギー消費がなく、費用対効果に優れている。
(3)選択性が高いため、純粋なリチウム抽出が保証され、不純物が最小限に抑えられる。
(4)スケールアップにも対応可能。
といったところのようです。
所感です。
電極の間に液を流すだけで、純度の高いリチウムイオンを選択席に取り込めることは非常に興味深い結果です。装置構成や操作が簡便であることは実用性が極めて高いと思われます。
ただ、最も重要な心臓部分は高密度セラミックLi6/16Sr7/16Ta3/4Hf1/4O3(LSTH)ペロブスカイト膜であったことです。ただ、今回の研究例ではこのLSTHがどのようにして開発されたのか?その経緯を把握できませんでした。少しばかり調べても見たのですが、良くわかっておりません。もし詳しい方はおられましたら、是非ともご教示いただければ幸いに存じます。
pdfはこちら
一覧に戻る







