新着情報
Informations

雑誌会
2024.03.24
リン酸塩を保護基として糖鎖合成
Phosphates as Assisting Groups in Glycan Synthesis
Eric T. Sletten,§ Giulio Fittolani,§ Nives Hribernik, Marlene C. S. Dal Colle, Peter H. Seeberger,*and Martina Delbianco*
ACS Cent. Sci. 2024, 10, 138−142
糖鎖合成において凝集を防ぐためにリン酸塩を保護基として導入したお話です。
(本文)
https://pubs.acs.org/doi/epdf/10.1021/acscentsci.3c00896
(追加情報)
その1
https://pubs.acs.org/doi/suppl/10.1021/acscentsci.3c00896/suppl_file/oc3c00896_si_001.pdf
その2
https://pubs.acs.org/doi/suppl/10.1021/acscentsci.3c00896/suppl_file/oc3c00896_si_002.pdf
今回の研究例は糖鎖のお話です。
糖鎖については、『「糖鎖」は、糖が生命の規則に従ってつながった鎖です。』とあります。
https://j-glyconet.jp/glycobiology/
あるいは、下記の資料もあります。
糖鎖の基礎知識
https://www.med.hirosaki-u.ac.jp/~uro/docs/research/index/Glyco_info_Hatakeyama.pdf
なおグリカンについては、『グリカン(Glycan)を日本語に翻訳すると「糖鎖」という言葉があてはまる。すなわち、グリカン(Glycan)は、炭水化物(carbohydrate)や糖(sugara)という言葉が意味するところと異なり、「くさり」を強く意識したことばである。すなわち、グリカン(Glycan)とは、糖が連なることによる新しい機能性、構造性の発現を意識した言葉であると言える。』とあります。
http://jsv.umin.jp/journal/v53-2pdf/virus53-2_127-131.pdf
そのグリカンを自動で合成できるようで、Automated glycan assembly(AGA、自動グリカンアセンブリ→自動グリカン合成?)と呼ばれています。
下記『糖鎖合成の新展開』のほぼ最後のところに『最近では,これら糖鎖を自動合成装置で合成する試みも展開され,装置の市販品も出てきている。』とあります。
https://seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2020.920378/data/index.html
更に参考文献37を見ると、Glyconeer 2.1 automated glycan synthesizerがその装置のようです。
https://www.pnas.org/doi/full/10.1073/pnas.1700141114
序論と見ますと、どうやら糖鎖の合成、副反応も起こってしまうので、保護基を導入して、余計な反応が起こらないようにするみたいです。
保護基については、下記『保護基のお話』で説明されています。
https://www.chem-station.com/blog/2008/06/protectinggroup.html
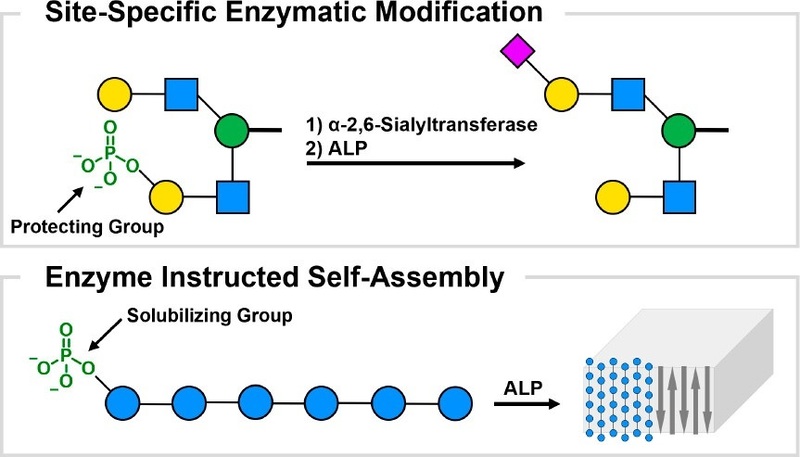
なお序論を見ると、自動グリカン合成(Automated glycan assembly、AGA)において、脱保護工程で凝集が起こり、収率が著しく低下することが問題となっているようです。そこでリン酸モノエステルを保護基とすれば、イオン性官能基なので、容易に開裂できると考え、リン酸モノエステルの導入を検討したようです。開裂はアルカリホスファターゼ(ALP)によって酵素的に行われたようです。
ここで、アルカリホスファターゼ(alkaline phosphatase (ALP))について『ALP(アルカリフォスファターゼ)は、有機リン酸エステルを加水分解してリン酸を遊離させる酵素』とあります。
http://serotec-labo.com/?page_id=1687
合成経路が図2に出ています。
まず図2Aを見ます。
出発物質が化合物1で、そこへAGA法で化合物2、3、4をくっ付けて鎖を伸ばして行き、その後リン酸部位を導入して化合物6を得たようです。
ここまでで、収率4%とはかなり低いような気がしますが…
図2Bへ進みます。
化合物6にα2,6-シアル酸の導入を試みたようです。
シアル酸については『シアル酸とは、細胞表面の糖鎖末端に存在する糖の一種(酸性糖)で、人の細胞のほかに、母乳や卵などに存在しています。その機能を簡単に述べるとすれば、「細胞の表面に存在することで、細胞に何かがくっつくときにこれを介する働きをする」ということです。』とあります。
http://www.sanyofine.co.jp/work/sialic_acid/sialic_acid.html
そして本文には『細菌由来(Photobacterium damselae)の市販のシアル酸転移酵素(Pd2,6ST)を用いて、リン酸化糖鎖へのα-2,6-シアル酸の導入を試みた。』とあります。
この『Pd2,6ST』ですが、調べてみましたが、やっとのことで、『α2,6-シアリルトランスフェラーゼ(ST)Pd2,6ST』という記述が見つかりました。
https://jglobal.jst.go.jp/detail?JGLOBAL_ID=202302245471483243
そこで、α-2,6-シアリルトランスフェラーゼについて調べましたところ、『α-2,6-シアリルトランスフェラーゼ Photobacterium damsela由来』と出てきましたので、このことだろうと思います。
https://www.sigmaaldrich.com/JP/ja/product/sigma/s2076
あるいは、下記もありましたが…
α2,6-シアル酸転移酵素
https://www.funakoshi.co.jp/contents/8171
更に本文には『複数のガラクトース残基が存在する場合、いくつかの残基のシアル化は収率の低下と困難な精製を必要とする。』とあります。
複数反応箇所があるとよろしくないということのようです。
ここで再び図2Bを見ます。
黄色の〇のところにPd2,6STを用いて、ピンク色の◆-CMPを導入しています。
一方、黄色の〇に-2O3PO-がある場合はそこには◆-CMPが繋がらない=リン酸が保護基として働いているということのようです。(図1左)
ここで化合物4を見ますと、OAc(アセトキシ基?)の部分が反応するようです。
そして図2Bの2段階に限って見れば、収率は97%と反応箇所を複数から一箇所へ絞ることで、収率の低下と困難な精製を改善することができたようです。
続いて『酵素による自己組織化』を検討しています。
部分的に保護された中間体または疎水性の結晶性グリカンは凝集するらしく、化学的にグリカンの合成を行おうとしても、収率は著しく低下するようです。特にグリカン構造の長さが増加すればするほど事態は悪化するようです。普通の溶媒では凝集が激しいため、長さが 6 量体を超えるセルロース オリゴマー (すなわちβ-1,4-オリゴグルコシド) の合成は難しいとされてきたようです。
そこで、イオン性リン酸モノエステルの導入により、水性の液中でのオリゴマーの溶解度の向上が期待でき、脱保護中および脱保護後の望ましくない凝集が改善できると考え、検討したようです。
図3Bを見ます。化合物18(Cellulose octasaccharide、セルロース八糖類)は反応液中での溶解度が低いために従来は収率が非常に低いことがあったので、まずはこの化合物18の合成を試みたようです。化合物18の脱リン酸化する前の化合物17は溶解性が>100 mg/mLと高く、反応は首尾良く進んだようです。
この化合物17までは20段の合成を経たものの、収率も17%だったようです。
17%と聞くと低いようですが、おそらくこれまで限りなく0%に近かったことを思えば、改善されたということでしょう。
続いてALPで処理しても収率を大きく落とすことなく、化合物18は36%で得られたようです。
更に同じやり方で、29段の合成を経て、収率が1%ながら化合物20(ドデカ糖)を得ることにも成功したようです。
ただ、この後、脱リン酸化して化合物21を得るには37℃×72時間と、いささか時間がかかったようです。(追加情報のS66ページ、図S18)
また、AFM観察により、オリゴマーの長さと相関する明確な高さを持つプレートレット(フラットな構造?)の形成が確認されたようです。
更にALPによる脱リン酸化について、温度、濃度、酵素量を変えても、得られた結晶には違いが見られず、ALPによる脱リン酸化が酵素による自己組織化の手法として良好であることがわかったようです。
所感です。
時々保護基を入れて、後で外す反応例を見ますが、くっつけて、また外す、実に面倒なことだなぁと思っておりました。どうも合成が心底好きな人には苦でもないようですが…
そして、今回の研究例で自動グリカン合成というものを知りました。29ステップとかありましたが、自動だと『まぁええか…』という気にもなります。
大学の時に交響楽団というクラブに入っていたのですが、クラブの先輩に生物系(バイオ系)の人がいました。『生物というのは、さほど厳密にしなくても、生き物の方で自ら合わせてくれる』とか言っていました。要は仕込みなど、多少誤差があっても、自然にうまく行くということでしょうか?自己組織化もバイオ系で見られる現象からも、あながち間違いではないような気がします。故に、自動化もやりやすかったのではないか?そんな気がしております。
Eric T. Sletten,§ Giulio Fittolani,§ Nives Hribernik, Marlene C. S. Dal Colle, Peter H. Seeberger,*and Martina Delbianco*
ACS Cent. Sci. 2024, 10, 138−142
糖鎖合成において凝集を防ぐためにリン酸塩を保護基として導入したお話です。
(本文)
https://pubs.acs.org/doi/epdf/10.1021/acscentsci.3c00896
(追加情報)
その1
https://pubs.acs.org/doi/suppl/10.1021/acscentsci.3c00896/suppl_file/oc3c00896_si_001.pdf
その2
https://pubs.acs.org/doi/suppl/10.1021/acscentsci.3c00896/suppl_file/oc3c00896_si_002.pdf
今回の研究例は糖鎖のお話です。
糖鎖については、『「糖鎖」は、糖が生命の規則に従ってつながった鎖です。』とあります。
https://j-glyconet.jp/glycobiology/
あるいは、下記の資料もあります。
糖鎖の基礎知識
https://www.med.hirosaki-u.ac.jp/~uro/docs/research/index/Glyco_info_Hatakeyama.pdf
なおグリカンについては、『グリカン(Glycan)を日本語に翻訳すると「糖鎖」という言葉があてはまる。すなわち、グリカン(Glycan)は、炭水化物(carbohydrate)や糖(sugara)という言葉が意味するところと異なり、「くさり」を強く意識したことばである。すなわち、グリカン(Glycan)とは、糖が連なることによる新しい機能性、構造性の発現を意識した言葉であると言える。』とあります。
http://jsv.umin.jp/journal/v53-2pdf/virus53-2_127-131.pdf
そのグリカンを自動で合成できるようで、Automated glycan assembly(AGA、自動グリカンアセンブリ→自動グリカン合成?)と呼ばれています。
下記『糖鎖合成の新展開』のほぼ最後のところに『最近では,これら糖鎖を自動合成装置で合成する試みも展開され,装置の市販品も出てきている。』とあります。
https://seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2020.920378/data/index.html
更に参考文献37を見ると、Glyconeer 2.1 automated glycan synthesizerがその装置のようです。
https://www.pnas.org/doi/full/10.1073/pnas.1700141114
序論と見ますと、どうやら糖鎖の合成、副反応も起こってしまうので、保護基を導入して、余計な反応が起こらないようにするみたいです。
保護基については、下記『保護基のお話』で説明されています。
https://www.chem-station.com/blog/2008/06/protectinggroup.html
なお序論を見ると、自動グリカン合成(Automated glycan assembly、AGA)において、脱保護工程で凝集が起こり、収率が著しく低下することが問題となっているようです。そこでリン酸モノエステルを保護基とすれば、イオン性官能基なので、容易に開裂できると考え、リン酸モノエステルの導入を検討したようです。開裂はアルカリホスファターゼ(ALP)によって酵素的に行われたようです。
ここで、アルカリホスファターゼ(alkaline phosphatase (ALP))について『ALP(アルカリフォスファターゼ)は、有機リン酸エステルを加水分解してリン酸を遊離させる酵素』とあります。
http://serotec-labo.com/?page_id=1687
合成経路が図2に出ています。
まず図2Aを見ます。
出発物質が化合物1で、そこへAGA法で化合物2、3、4をくっ付けて鎖を伸ばして行き、その後リン酸部位を導入して化合物6を得たようです。
ここまでで、収率4%とはかなり低いような気がしますが…
図2Bへ進みます。
化合物6にα2,6-シアル酸の導入を試みたようです。
シアル酸については『シアル酸とは、細胞表面の糖鎖末端に存在する糖の一種(酸性糖)で、人の細胞のほかに、母乳や卵などに存在しています。その機能を簡単に述べるとすれば、「細胞の表面に存在することで、細胞に何かがくっつくときにこれを介する働きをする」ということです。』とあります。
http://www.sanyofine.co.jp/work/sialic_acid/sialic_acid.html
そして本文には『細菌由来(Photobacterium damselae)の市販のシアル酸転移酵素(Pd2,6ST)を用いて、リン酸化糖鎖へのα-2,6-シアル酸の導入を試みた。』とあります。
この『Pd2,6ST』ですが、調べてみましたが、やっとのことで、『α2,6-シアリルトランスフェラーゼ(ST)Pd2,6ST』という記述が見つかりました。
https://jglobal.jst.go.jp/detail?JGLOBAL_ID=202302245471483243
そこで、α-2,6-シアリルトランスフェラーゼについて調べましたところ、『α-2,6-シアリルトランスフェラーゼ Photobacterium damsela由来』と出てきましたので、このことだろうと思います。
https://www.sigmaaldrich.com/JP/ja/product/sigma/s2076
あるいは、下記もありましたが…
α2,6-シアル酸転移酵素
https://www.funakoshi.co.jp/contents/8171
更に本文には『複数のガラクトース残基が存在する場合、いくつかの残基のシアル化は収率の低下と困難な精製を必要とする。』とあります。
複数反応箇所があるとよろしくないということのようです。
ここで再び図2Bを見ます。
黄色の〇のところにPd2,6STを用いて、ピンク色の◆-CMPを導入しています。
一方、黄色の〇に-2O3PO-がある場合はそこには◆-CMPが繋がらない=リン酸が保護基として働いているということのようです。(図1左)
ここで化合物4を見ますと、OAc(アセトキシ基?)の部分が反応するようです。
そして図2Bの2段階に限って見れば、収率は97%と反応箇所を複数から一箇所へ絞ることで、収率の低下と困難な精製を改善することができたようです。
続いて『酵素による自己組織化』を検討しています。
部分的に保護された中間体または疎水性の結晶性グリカンは凝集するらしく、化学的にグリカンの合成を行おうとしても、収率は著しく低下するようです。特にグリカン構造の長さが増加すればするほど事態は悪化するようです。普通の溶媒では凝集が激しいため、長さが 6 量体を超えるセルロース オリゴマー (すなわちβ-1,4-オリゴグルコシド) の合成は難しいとされてきたようです。
そこで、イオン性リン酸モノエステルの導入により、水性の液中でのオリゴマーの溶解度の向上が期待でき、脱保護中および脱保護後の望ましくない凝集が改善できると考え、検討したようです。
図3Bを見ます。化合物18(Cellulose octasaccharide、セルロース八糖類)は反応液中での溶解度が低いために従来は収率が非常に低いことがあったので、まずはこの化合物18の合成を試みたようです。化合物18の脱リン酸化する前の化合物17は溶解性が>100 mg/mLと高く、反応は首尾良く進んだようです。
この化合物17までは20段の合成を経たものの、収率も17%だったようです。
17%と聞くと低いようですが、おそらくこれまで限りなく0%に近かったことを思えば、改善されたということでしょう。
続いてALPで処理しても収率を大きく落とすことなく、化合物18は36%で得られたようです。
更に同じやり方で、29段の合成を経て、収率が1%ながら化合物20(ドデカ糖)を得ることにも成功したようです。
ただ、この後、脱リン酸化して化合物21を得るには37℃×72時間と、いささか時間がかかったようです。(追加情報のS66ページ、図S18)
また、AFM観察により、オリゴマーの長さと相関する明確な高さを持つプレートレット(フラットな構造?)の形成が確認されたようです。
更にALPによる脱リン酸化について、温度、濃度、酵素量を変えても、得られた結晶には違いが見られず、ALPによる脱リン酸化が酵素による自己組織化の手法として良好であることがわかったようです。
所感です。
時々保護基を入れて、後で外す反応例を見ますが、くっつけて、また外す、実に面倒なことだなぁと思っておりました。どうも合成が心底好きな人には苦でもないようですが…
そして、今回の研究例で自動グリカン合成というものを知りました。29ステップとかありましたが、自動だと『まぁええか…』という気にもなります。
大学の時に交響楽団というクラブに入っていたのですが、クラブの先輩に生物系(バイオ系)の人がいました。『生物というのは、さほど厳密にしなくても、生き物の方で自ら合わせてくれる』とか言っていました。要は仕込みなど、多少誤差があっても、自然にうまく行くということでしょうか?自己組織化もバイオ系で見られる現象からも、あながち間違いではないような気がします。故に、自動化もやりやすかったのではないか?そんな気がしております。
pdfはこちら
一覧に戻る







