新着情報
Informations

雑誌会
2024.09.19
スズ-ケイ酸塩で酸触媒
この『雑誌会の部屋』は、化学系の雑誌を中心に独断と偏見で研究例を選び、不定期でご紹介するコーナーです。
Esterification of Levulinic Acid with Different Alcohols Using
Mesoporous Stannosilicates As the Catalyst
Bruna Ezequielle Bernardes Costa, Antonio Osimar Souza da Silva,
and Simoni Margareti Plentz Meneghetti
ACS Omega 2024, 9, 31128−31135
エステル化反応の促進をスズ系の触媒でやろうというお話です。
(本文)
https://pubs.acs.org/doi/epdf/10.1021/acsomega.4c04598
(追加情報)
https://pubs.acs.org/doi/suppl/10.1021/acsomega.4c04598/suppl_file/ao4c04598_si_001.pdf
やったことは、ABSTRACTの右横にある反応式のように、レブリン酸とアルコール類をエステル化反応させる際に従来の塩酸や硫酸ではなく、スズ系化合物を用いた触媒で反応させたというお話です。
まずレブリン酸についてですが、レブリン酸を作るだけでも大量の酸が必要なようです。
(触媒変換プロセスによりセルロース系バイオマスからの有用化学品合成)
https://www.aist.go.jp/Portals/0/resource_images/aist_j/aistinfo/aist_today/vol13_06/vol13_06_p14.pdf
また、『レブリン酸は炭素数5のカルボン酸ですが、レブリン酸からは燃料添加剤、各種機能性樹脂材料、光合成促進剤、生分解性除草剤など多種多様な化学品が合成可能であり、バイオマス由来の基幹物質として高いポテンシャルを有しています。』とあります。
更にレブリン酸エステルについては、『セルロースや糖などの炭水化物を原料としてレブリン酸を合成する反応はこれまでも幾つか報告されてきましたが、いずれも量論量程度以上の多量の酸が必要とされてきました(Table 1)。しかしながら、私たちは、二種類の異なる酸を組み合わせることで、触媒量の酸によりセルロースから一段で収率よくレブリン酸エステルを合成する反応を開発することに成功いたしました(Table 2)。』とあります。
(ハイブリッド酸触媒によるセルロースからのレブリン酸エステル合成)
https://www.shokubai.org/meeting/topics/104_3D09.pdf
上記『ハイブリッド酸触媒によるセルロースからのレブリン酸エステル合成』は一気に二段階の反応を行った反応で、今回の研究例はその後半部分になります。
もっとも、後半のエステル化部分だけでも、ポピュラーな反応であり、今回の研究例は十分意義があると考えます。
結局のところ、触媒が重要な物質となります。
まず、メソポーラス材料を準備します。
ここではMCM-41と呼ばれるメソポーラスシリカを使ったようです。
(メソポーラス材料)
https://www.sigmaaldrich.com/JP/ja/technical-documents/technical-article/materials-science-and-engineering/tissue-engineering/mesoporous-materials?srsltid=AfmBOooJjJfUHEqiDgBu5WTB-JVFA_C2ZMOWKhFJvSgiCrV2hv0v7lK4
このMCM-41にスズ酸ナトリウム(Na2SnO3)を用いてスズを導入して、SnMCM-41を合成したようです。
(スズ酸ナトリウム 三水和物)
https://www.sigmaaldrich.com/JP/ja/product/aldrich/336262?srsltid=AfmBOooKupiTzO2CVglFNQ8cu_UEXHOVSogUbNNtJ5W27F1yWSXBYKl-]
参考文献14を見ればわかることになっていますが、おそらく下記(Sn-MCM-56)と類似であろうと思われます。
(Hydrothermal synthesis of MWW-type stannosilicate and its post-structural transformation to MCM-56 analogue)
https://www.sciencedirect.com/science/article/abs/pii/S1387181112005239
合成は25℃および80℃で行われたようで、25℃の場合はSnMCM-41-25、80℃の場合はSnMCM-41-80と名付けられたようです。ただ、スズを導入していない、MCM-41-25およびMCM-41-80もあるので、MCM-41を合成するにも25℃と80℃の二通りあったのでしょうか?そして、MCM-41を合成するのも、SnMCM-41を合成するのも、スズ酸ナトリウムを仕込むか仕込まないか?の違いだけなのでしょうか?
結果です。
まず、固体触媒の酸点評価(NH3-TPD)を行っています。
この固体触媒の酸点評価(NH3-TPD)ですが、『固体触媒の酸性質の評価は、触媒の設計や性能向上、触媒活性の把握に大変重要である。この酸性質の測定には昇温脱離法(TPD:Temperature Programmed Desorption)が用いられ、塩基性ガスのNH3を触媒の酸点に吸着させ脱離挙動を見ることで酸性質を把握する。このとき、NH3脱離量が試料の酸量、脱離温度が酸強度や強度分布の指標になる。』とあります。
(固体触媒の酸点評価(NH3-TPD))
https://www.ube.co.jp/usal/documents/b120_145.htm
図1に結果が出ています。
SnMCM-41-80とSnMCM-41-25の結果が出ています。
150℃~300℃の一番目のピークは弱い~中間の酸に一致します。
どちらのサンプルも観測されていたようです。
そして、400℃付近の二番目のピークは強い酸によるもので、SnMCM-41-80の方が強く出ていたようです。
表1に酸性部位の量を比較しています。強い酸の部位はSnMCM-41-80の方が多く、合成時に温度が高いほど酸性も強かったようです。
図2はFTIRの結果です。
SnのないMCM-41-25およびMCM-41-80の場合(図2AおよびB、表2)はピークが2つだけで、MCM-41構造におけるシラノールとピリジンとの間に発生する相互作用によるもので、いずれも弱いブレンステッド酸に由来するようです。
また、測定温度を上げるとピークの領域は小さく見えなくなる傾向にあり、相互作用は脆く、ブレンステッド酸のみの作用であることが示されているようです。
一方、Snを用いたSnMCM-41の場合はブレンステッド酸のみならず、ルイス酸に由来するピークも現れたようです。(図2CおよびD、表2)特に表2に見られますように、ブレンステッド酸とルイス酸の濃度はSnを加えたことで、大きくなり、酸としての能力を高めたようです。
なお、ブレンステッド酸については、『相手にH+を与える分子やイオン』とあります。
(5分でわかる!ブレンステッド・ローリーの定義)
https://www.try-it.jp/chapters-9049/sections-9116/lessons-9125/
ルイス酸については、
(ルイス酸・ルイス塩基とは何か?わかりやすい化学の解説)
https://butioblog.com/explanation/biginner/1-7
続いて実際にエステル化を行っています。
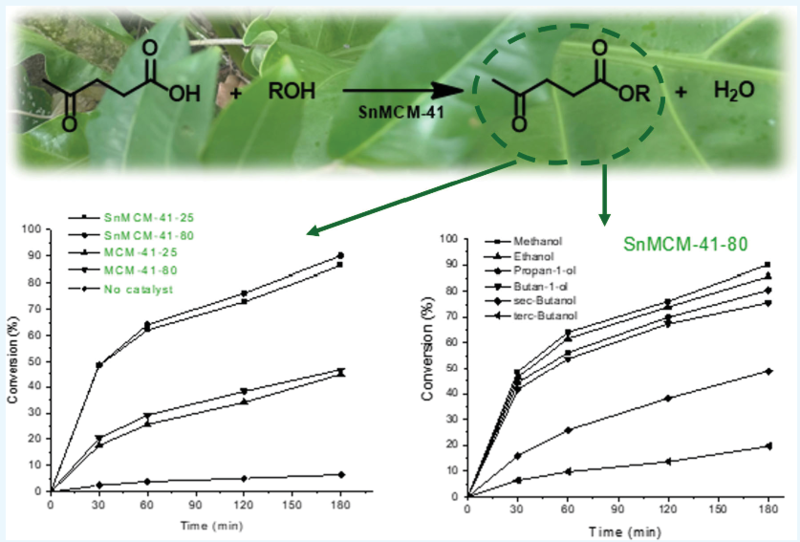
メタノールとレブリン酸のモル比を5/1、触媒量を1 wt%、反応温度を120℃として検討したようです。結果が図3に出ています。
特にSnMCM-41−80 の場合は変換率が76.1%(120分後)and 90.1% (180分後)となり、SnがないMCM-41−80の場合の38.3%(120分後)および46.6%(180分後)を大きく上回り、ほぼ2倍となったようです。これは上記で見たように、明らかにブレンステッド酸とルイス酸の相乗効果によるものみたいです。
そして、SnMCM-41を用いて、アルコールの種類について検討したようです。
SnMCM-41-25およびSnMCM-41-80のどちらにおいても、変換率はメタノール>エタノール>1-プロパノール>1-ブタノール>2-ブタノール>tert-ブタノールとなったようです。
アルコールの炭素数が増えると変換率は下がり、更に枝分かれすると、変換率の低下は顕著となったようです。
このアルコールの種類による変換率の違いについて、タフトの式によるタフトの関係を調べて考察しています。
タフトの式は反応性を評価するハメット則の発展型のようです。追加情報のS3ページあるいは、『R.W.Taftは、エステルRCOOEtの加水分解が酸性条件で極性効果をほとんど受けない(ρ≒0)一方、アルカリ加水分解は大きな極性効果を受ける(ρ≠0)ことに着目し、この反応速度の差をもとに立体効果の定量化を行い、Taftの式を提唱した。
Log KR/KH =ρ*σ*+δEs
ρ*σ*が極性効果、δEsが立体効果の度合いを示す。両効果が完全に分離された表現がなされているのがTaftの式の特徴である。』とあります。
(ハメット則)
https://www.chem-station.com/blog/2002/04/Hammett_equation.html
結果が図5に示されており、図4で見られた傾向が反映されていたようです。
最後にリサイクル性を調べたようです。
結果が図6に示されていますが、アルコールの種類に関係なく、十分なリサイクル性があったようです。
所感です。
今更ながらではありますが、化学にとって反応は中枢そのもので、如何に反応容易に進めるか?は大昔から続く永遠の課題と言っても過言ではありません。その中で触媒は実に不思議な存在です。ただ、その触媒も年々複雑化しており、触媒そのものの合成も容易でない場合が多々あります。省エネあるいはCO2の抑制が重要視されている昨今、優れた触媒はその解決に寄与するものですが、触媒の製造に多量のエネルギーを使っていたのでは、本末転倒です。
その観点からも、今回の研究例は触媒の準備は比較的容易で、除去も簡単、リサイクル性もあるということで、非常に興味深い結果と考えます。
Esterification of Levulinic Acid with Different Alcohols Using
Mesoporous Stannosilicates As the Catalyst
Bruna Ezequielle Bernardes Costa, Antonio Osimar Souza da Silva,
and Simoni Margareti Plentz Meneghetti
ACS Omega 2024, 9, 31128−31135
エステル化反応の促進をスズ系の触媒でやろうというお話です。
(本文)
https://pubs.acs.org/doi/epdf/10.1021/acsomega.4c04598
(追加情報)
https://pubs.acs.org/doi/suppl/10.1021/acsomega.4c04598/suppl_file/ao4c04598_si_001.pdf
やったことは、ABSTRACTの右横にある反応式のように、レブリン酸とアルコール類をエステル化反応させる際に従来の塩酸や硫酸ではなく、スズ系化合物を用いた触媒で反応させたというお話です。
まずレブリン酸についてですが、レブリン酸を作るだけでも大量の酸が必要なようです。
(触媒変換プロセスによりセルロース系バイオマスからの有用化学品合成)
https://www.aist.go.jp/Portals/0/resource_images/aist_j/aistinfo/aist_today/vol13_06/vol13_06_p14.pdf
また、『レブリン酸は炭素数5のカルボン酸ですが、レブリン酸からは燃料添加剤、各種機能性樹脂材料、光合成促進剤、生分解性除草剤など多種多様な化学品が合成可能であり、バイオマス由来の基幹物質として高いポテンシャルを有しています。』とあります。
更にレブリン酸エステルについては、『セルロースや糖などの炭水化物を原料としてレブリン酸を合成する反応はこれまでも幾つか報告されてきましたが、いずれも量論量程度以上の多量の酸が必要とされてきました(Table 1)。しかしながら、私たちは、二種類の異なる酸を組み合わせることで、触媒量の酸によりセルロースから一段で収率よくレブリン酸エステルを合成する反応を開発することに成功いたしました(Table 2)。』とあります。
(ハイブリッド酸触媒によるセルロースからのレブリン酸エステル合成)
https://www.shokubai.org/meeting/topics/104_3D09.pdf
上記『ハイブリッド酸触媒によるセルロースからのレブリン酸エステル合成』は一気に二段階の反応を行った反応で、今回の研究例はその後半部分になります。
もっとも、後半のエステル化部分だけでも、ポピュラーな反応であり、今回の研究例は十分意義があると考えます。
結局のところ、触媒が重要な物質となります。
まず、メソポーラス材料を準備します。
ここではMCM-41と呼ばれるメソポーラスシリカを使ったようです。
(メソポーラス材料)
https://www.sigmaaldrich.com/JP/ja/technical-documents/technical-article/materials-science-and-engineering/tissue-engineering/mesoporous-materials?srsltid=AfmBOooJjJfUHEqiDgBu5WTB-JVFA_C2ZMOWKhFJvSgiCrV2hv0v7lK4
このMCM-41にスズ酸ナトリウム(Na2SnO3)を用いてスズを導入して、SnMCM-41を合成したようです。
(スズ酸ナトリウム 三水和物)
https://www.sigmaaldrich.com/JP/ja/product/aldrich/336262?srsltid=AfmBOooKupiTzO2CVglFNQ8cu_UEXHOVSogUbNNtJ5W27F1yWSXBYKl-]
参考文献14を見ればわかることになっていますが、おそらく下記(Sn-MCM-56)と類似であろうと思われます。
(Hydrothermal synthesis of MWW-type stannosilicate and its post-structural transformation to MCM-56 analogue)
https://www.sciencedirect.com/science/article/abs/pii/S1387181112005239
合成は25℃および80℃で行われたようで、25℃の場合はSnMCM-41-25、80℃の場合はSnMCM-41-80と名付けられたようです。ただ、スズを導入していない、MCM-41-25およびMCM-41-80もあるので、MCM-41を合成するにも25℃と80℃の二通りあったのでしょうか?そして、MCM-41を合成するのも、SnMCM-41を合成するのも、スズ酸ナトリウムを仕込むか仕込まないか?の違いだけなのでしょうか?
結果です。
まず、固体触媒の酸点評価(NH3-TPD)を行っています。
この固体触媒の酸点評価(NH3-TPD)ですが、『固体触媒の酸性質の評価は、触媒の設計や性能向上、触媒活性の把握に大変重要である。この酸性質の測定には昇温脱離法(TPD:Temperature Programmed Desorption)が用いられ、塩基性ガスのNH3を触媒の酸点に吸着させ脱離挙動を見ることで酸性質を把握する。このとき、NH3脱離量が試料の酸量、脱離温度が酸強度や強度分布の指標になる。』とあります。
(固体触媒の酸点評価(NH3-TPD))
https://www.ube.co.jp/usal/documents/b120_145.htm
図1に結果が出ています。
SnMCM-41-80とSnMCM-41-25の結果が出ています。
150℃~300℃の一番目のピークは弱い~中間の酸に一致します。
どちらのサンプルも観測されていたようです。
そして、400℃付近の二番目のピークは強い酸によるもので、SnMCM-41-80の方が強く出ていたようです。
表1に酸性部位の量を比較しています。強い酸の部位はSnMCM-41-80の方が多く、合成時に温度が高いほど酸性も強かったようです。
図2はFTIRの結果です。
SnのないMCM-41-25およびMCM-41-80の場合(図2AおよびB、表2)はピークが2つだけで、MCM-41構造におけるシラノールとピリジンとの間に発生する相互作用によるもので、いずれも弱いブレンステッド酸に由来するようです。
また、測定温度を上げるとピークの領域は小さく見えなくなる傾向にあり、相互作用は脆く、ブレンステッド酸のみの作用であることが示されているようです。
一方、Snを用いたSnMCM-41の場合はブレンステッド酸のみならず、ルイス酸に由来するピークも現れたようです。(図2CおよびD、表2)特に表2に見られますように、ブレンステッド酸とルイス酸の濃度はSnを加えたことで、大きくなり、酸としての能力を高めたようです。
なお、ブレンステッド酸については、『相手にH+を与える分子やイオン』とあります。
(5分でわかる!ブレンステッド・ローリーの定義)
https://www.try-it.jp/chapters-9049/sections-9116/lessons-9125/
ルイス酸については、
(ルイス酸・ルイス塩基とは何か?わかりやすい化学の解説)
https://butioblog.com/explanation/biginner/1-7
続いて実際にエステル化を行っています。
メタノールとレブリン酸のモル比を5/1、触媒量を1 wt%、反応温度を120℃として検討したようです。結果が図3に出ています。
特にSnMCM-41−80 の場合は変換率が76.1%(120分後)and 90.1% (180分後)となり、SnがないMCM-41−80の場合の38.3%(120分後)および46.6%(180分後)を大きく上回り、ほぼ2倍となったようです。これは上記で見たように、明らかにブレンステッド酸とルイス酸の相乗効果によるものみたいです。
そして、SnMCM-41を用いて、アルコールの種類について検討したようです。
SnMCM-41-25およびSnMCM-41-80のどちらにおいても、変換率はメタノール>エタノール>1-プロパノール>1-ブタノール>2-ブタノール>tert-ブタノールとなったようです。
アルコールの炭素数が増えると変換率は下がり、更に枝分かれすると、変換率の低下は顕著となったようです。
このアルコールの種類による変換率の違いについて、タフトの式によるタフトの関係を調べて考察しています。
タフトの式は反応性を評価するハメット則の発展型のようです。追加情報のS3ページあるいは、『R.W.Taftは、エステルRCOOEtの加水分解が酸性条件で極性効果をほとんど受けない(ρ≒0)一方、アルカリ加水分解は大きな極性効果を受ける(ρ≠0)ことに着目し、この反応速度の差をもとに立体効果の定量化を行い、Taftの式を提唱した。
Log KR/KH =ρ*σ*+δEs
ρ*σ*が極性効果、δEsが立体効果の度合いを示す。両効果が完全に分離された表現がなされているのがTaftの式の特徴である。』とあります。
(ハメット則)
https://www.chem-station.com/blog/2002/04/Hammett_equation.html
結果が図5に示されており、図4で見られた傾向が反映されていたようです。
最後にリサイクル性を調べたようです。
結果が図6に示されていますが、アルコールの種類に関係なく、十分なリサイクル性があったようです。
所感です。
今更ながらではありますが、化学にとって反応は中枢そのもので、如何に反応容易に進めるか?は大昔から続く永遠の課題と言っても過言ではありません。その中で触媒は実に不思議な存在です。ただ、その触媒も年々複雑化しており、触媒そのものの合成も容易でない場合が多々あります。省エネあるいはCO2の抑制が重要視されている昨今、優れた触媒はその解決に寄与するものですが、触媒の製造に多量のエネルギーを使っていたのでは、本末転倒です。
その観点からも、今回の研究例は触媒の準備は比較的容易で、除去も簡単、リサイクル性もあるということで、非常に興味深い結果と考えます。
pdfはこちら
一覧に戻る







